Structure de résonance du phénol

1.Impressions de la structure de résonance du phénol
1. la large application de phénol
Phénol, le «tout-ronged» dans le domaine de la chimie organique, brille dans beaucoup de domaines. Dans le domaine de la médecine, c'est la matière première principale pour la synthèse de l'aspirine et d'autres drogues importantes, escortant la santé humaine; dans l'industrie chimique, c'est la «force principale» dans la production de la résine phénolique, aidant le développement de la science matérielle; dans la vie quotidienne, Il est également employé en tant que les matières premières désinfectantes gardent notre santé et sécurité. Avec une telle gamme d'applications, le phénol est devenu l'un des points chauds de la recherche en chimie organique.
2. conduire au concept de structure de résonance
Dans le monde merveilleux de la chimie organique, les structures résonantes sont un modèle théorique unique. C'est comme une clé magique qui peut nous aider à ouvrir la porte au mystère de la distribution électronique à l'intérieur de la molécule. Pour le phénol, la structure de résonance est la clé pour comprendre ses propriétés.
3. Proposer le but de l'étude
Dans cet article, nous analyserons en profondeur la structure de résonance du phénol, explorerons la relation interne entre celui-ci et les propriétés du phénol et fournirons une base théorique pour mieux comprendre et utiliser le phénol.
2.Formation, caractéristiques et effets de la structure de résonance du phénol
1. mécanisme de formation de la structure de résonance du phénol
(1) Base de la structure moléculaire
Phénol est constitué d'un cycle benzénique et d'un groupe hydroxyle. L'anneau de benzène a une grande & pi; structure unique de liaison dans laquelle les électrons peuvent se déplacer librement dans tout l'anneau. Les atomes d'oxygène, d'autre part, ont des paires d'électrons solitaires, qui sont comme des «elfes» cachés dans l'obscurité, attendant une réaction merveilleuse avec l'anneau de benzène.
(2) Processus délocalisé d'électrons
Quand la molécule de phénol est formée, les électrons seuls de paire de l'atome de l'oxygène agissent l'un sur l'autre fortement avec le grand & pi; bond de l'anneau de benzène. Les électrons ne sont plus confinés à un atome particulier, mais sont redistribués dans la molécule, formant des formules de limites de résonance multiples. C'est comme une merveilleuse performance de danse, une navette électronique gratuite dans les molécules, une "danse électronique" unique.
(3) Superposition du type de limite de résonance
Ces formules de limite de résonance n'existent pas indépendamment, mais sont superposées les unes aux autres par résonance. Ils sont comme un groupe de «membres d'équipe» travaillant ensemble pour décrire la vraie distribution de nuage d'électrons de la molécule de phénol. C'est cette superposition qui donne à la molécule de phénol ses propriétés uniques.
2. caractéristiques de structure de résonance de phénol
(1) Haute densité du nuage d'électrons para adjacent
En raison de l'effet de résonance, la densité des nuages d'électrons des positions adjacentes et para sur l'anneau de benzène augmente de manière significative. D'après le diagramme schématique, les nuages d'électrons dans ces deux positions sont comme des ampoules "allumées", qui attirent particulièrement l'attention. Cette forte densité de nuages d'électrons rend les sites ortho et para plus actifs dans les réactions chimiques.
(2) la délocalisation de la charge négative
Charge négative sur l'anneau de benzène s'est produite phénomène délocalisé, comme un groupe d'oiseaux libres, volant librement dans le «ciel» de l'anneau de benzène. Cette délocalisation réduit l'énergie moléculaire et rend la structure plus stable, ce qui jette les bases des propriétés chimiques du phénol.
3. effet de la structure de résonance sur les propriétés du phénol
(1) Réactivité
Réaction de substitution électrophile: La haute densité du nuage d'électrons ortho-para rend le phénol plus enclin à la réaction de substitution électrophile. Par exemple, dans les réactions de nitration, sulfonation et autres, les réactifs attaqueront préférentiellement les positions ortho et para pour générer des produits correspondants, et les produits sont principalement concentrés dans les positions ortho et para.
Sélectivité de réaction: Dans certaines réactions, le phénol présente une sélectivité de réaction spécifique due à la structure de résonance. Tout comme un mangeur difficile, ne choisissant que la «nourriture» qu'il aime, cette sélectivité offre plus de possibilités pour la synthèse organique.
2) Acidité
La structure de résonance facilite la dissociation de l'hydrogène hydroxylé phénolique, ce qui améliore l'acidité du phénol. Par rapport aux alcools, le phénol est beaucoup plus acide, comme une molécule plus «piquante», plus susceptible de libérer des ions hydrogène.
3) Stabilité
L'énergie de stabilisation de résonance réduit l'énergie de la molécule de phénol, rendant sa structure plus stable et moins sujette à la décomposition ou au changement. Cela rend le phénol plus fiable dans le stockage et l'utilisation, et fournit une garantie pour sa large application.
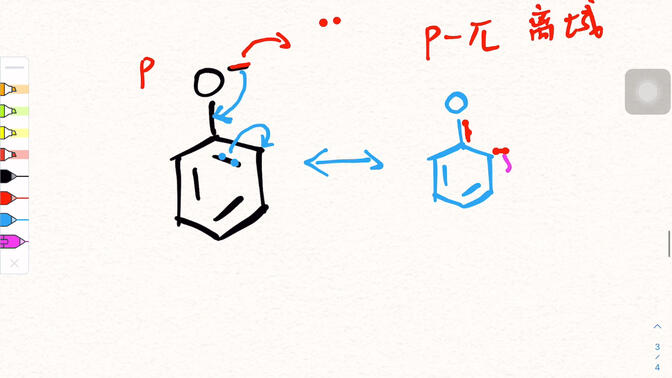
4. dessiner la structure de résonance du phénol
La structure de résonance du phénol peut être présentée à l'aide d'un diagramme schématique simple.
La structure de base du phénol est un groupe hydroxyle (- OH) attaché au cycle benzénique.
Une équation de limite de résonance est la structure originale du phénol, dans laquelle les électrons de la paire d'atomes d'oxygène ne participent pas à la délocalisation;
Dans une autre équation limite, le seul électron paire de l'atome d'oxygène interagit avec le grand & pi; -liaison de l'anneau de benzène, formant une double liaison partielle caractéristique entre l'atome d'oxygène et le cycle de benzène. Dans le même temps, la densité des nuages d'électrons adjacents et para sur l'anneau de benzène augmente et la direction du mouvement des électrons est indiquée par des flèches. Des équations aux limites multiples sont superposées pour décrire la distribution réelle du nuage électronique du phénol.
3. la manifestation de la structure de résonance dans la réaction de phénol
1. Cas d'intervention spécifiques
La réaction du phénol avec l'eau de brome est un cas classique. Lorsque l'eau de brome est ajoutée goutte à goutte à la solution de phénol, un précipité blanc est immédiatement produit, qui est tribromophénol.
2. combiné avec l'analyse de structure de résonance
Du point de vue de la structure de résonance, l'atome de brome est plus susceptible d'attaquer ces deux positions en raison de la forte densité des nuages d'ortho-et de para-électrons du phénol. Au cours de la réaction, les atomes de brome remplacent progressivement les atomes d'hydrogène sur le cycle benzénique, et finalement un précipité blanc de tribromophénol est généré. Ce processus démontre clairement le rôle important de la structure de résonance dans l'explication de la réaction chimique du phénol.
3. Mettre l'accent sur le rôle des structures résonantes
À travers ce cas, nous avons une compréhension plus profonde de la structure de résonance est non seulement un concept théorique, mais aussi la clé pour comprendre la nature de la réaction chimique du phénol. C'est comme un conducteur silencieux, guidant la réaction chimique.
4. la valeur et la perspective d'étudier la structure de résonance du phénol
La structure de résonance permet au phénol d'avoir une réactivité, une acidité et une stabilité uniques, ce qui détermine en outre l'application du phénol dans divers domaines. À l'avenir, nous pourrons combiner des méthodes de chimie computationnelle avancées et des techniques expérimentales pour étudier plus avant la structure de résonance du phénol. Cela nous aidera à comprendre la nature et le comportement du phénol de manière plus complète, fournir un soutien plus théorique et des conseils pratiques pour le développement de la chimie organique, et laisser le «généraliste» du phénol jouer un rôle plus important dans plus de domaines.

