Struttura di risonanza del fenolo

1. Impressioni della struttura di risonanza fenolica
1. l'ampia applicazione del fenolo
Fenolo, il "tutto ronged" nel campo della chimica organica, brilla in molti campi. Nel campo della medicina, è la materia prima chiave per la sintesi dell'aspirina e di altri farmaci importanti, scortando la salute umana; nell'industria chimica, è la "forza principale" nella produzione di resina fenolica, aiutando lo sviluppo della scienza dei materiali; nella vita quotidiana, È anche usato come disinfettante per proteggere la nostra salute e sicurezza. Con una gamma così ampia di applicazioni, il fenolo è diventato uno dei punti caldi nella ricerca di chimica organica.
2. Portare al concetto di struttura di risonanza
Nel meraviglioso mondo della chimica organica, le strutture risonanti sono un modello teorico unico. È come una chiave magica che può aiutarci ad aprire la porta al mistero della distribuzione degli elettroni all'interno della molecola. Per il fenolo, la struttura di risonanza è la chiave per comprenderne le proprietà.
3. Proporre lo scopo dello studio
In questo articolo, analizzeremo in profondità la struttura di risonanza del fenolo, esploreremo la relazione interna tra esso e le proprietà del fenolo e ci forniremo una base teorica per comprendere e utilizzare meglio il fenolo.
2. Formazione, caratteristiche ed effetti della struttura di risonanza del fenolo
1. Meccanismo di formazione della struttura di risonanza del fenolo
(1) Base della struttura molecolare
Fenolo è costituito da un anello benzenico e un gruppo idrossile. L'anello benzenico ha una grande struttura unica di legame & pi; in cui gli elettroni possono muoversi liberamente in tutto l'anello. Gli atomi di ossigeno, d'altra parte, hanno coppie solitarie di elettroni, che sono come "elfi" nascosti nel buio, in attesa di una meravigliosa reazione con l'anello benzenico.
(2) Processo delocalizzato dell'elettrone
Quando si forma la molecola di fenolo, gli elettroni della coppia solitaria dell'atomo di ossigeno interagiscono fortemente con il grande legame & pi; dell'anello benzenico. Gli elettroni non sono più confinati in un particolare atomo, ma vengono ridistribuiti all'interno della molecola, formando più formule limite di risonanza. È come una meravigliosa esibizione di danza, navetta elettronica gratuita nelle molecole, che esegue una "danza elettronica" unica.
(3) Superposizione del tipo di limite di risonanza
Queste formule limite di risonanza non esistono in modo indipendente, ma si sovrappongono l'una all'altra attraverso la risonanza. Sono come un gruppo di "membri del team" che lavorano insieme per descrivere la vera distribuzione della nuvola di elettroni della molecola di fenolo. È questa sovrapposizione che conferisce alla molecola di fenolo le sue proprietà uniche.
2. Caratteristiche della struttura di risonanza del fenolo
(1) Alta densità di nuvola di elettroni para adiacenti
A causa dell'effetto di risonanza, la densità della nuvola di elettroni delle posizioni adiacenti e para sull'anello benzenico aumenta in modo significativo. Dal diagramma schematico, le nuvole di elettroni in queste due posizioni sono come lampadine "accese", che sono particolarmente accattivanti. Questa elevata densità di nuvole di elettroni rende i siti orto e para più attivi nelle reazioni chimiche.
(2) la delocalizzazione della carica negativa
Carica negativa sul benzene anello si è verificato fenomeno delocalizzato, come un gruppo di uccelli liberi, volando liberamente nel "cielo" dell'anello benzenico. Questa delocalità riduce l'energia molecolare e rende la struttura più stabile, il che pone le basi per le proprietà chimiche del fenolo.
3. Effetto della struttura di risonanza sulle proprietà del fenolo
(1) Reattività
Reazione di sostituzione elettrofila: l'alta densità della nuvola di elettroni orto-para rende il fenolo più incline alla reazione di sostituzione elettrofila. Ad esempio, nella nitrazione, nella solfonazione e in altre reazioni, i reagenti attaccheranno preferenzialmente le posizioni orto e para per generare prodotti corrispondenti, ei prodotti sono concentrati principalmente nelle posizioni orto e para.
Selettività di reazione: in alcune reazioni, il fenolo mostra una selettività di reazione specifica dovuta alla struttura di risonanza. Proprio come un mangiatore esigente, scegliendo solo il "cibo" che gli piace, questa selettività offre più possibilità di sintesi organica.
Acidità (2)
La struttura di risonanza facilita la dissociazione dell'idrogeno idrossilico fenolico, migliorando così l'acidità del fenolo. Rispetto agli alcoli, il fenolo è significativamente più acido, come una molecola più "pungente", con maggiori probabilità di rilasciare ioni idrogeno.
(3) Stabilità
L'energia di stabilizzazione di risonanza riduce l'energia della molecola di fenolo, rendendo la sua struttura più stabile e meno incline alla decomposizione o al cambiamento. Ciò rende il fenolo più affidabile nello stoccaggio e nell'uso e fornisce una garanzia per la sua ampia applicazione.
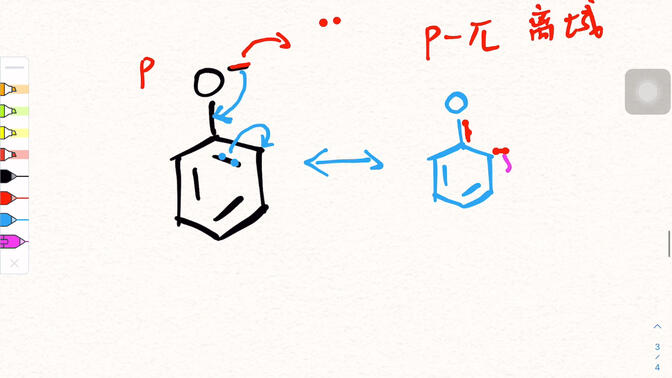
4. Disegna la struttura di risonanza del fenolo
La struttura di risonanza del fenolo può essere presentata attraverso un semplice diagramma schematico.
La struttura di base del fenolo è un gruppo idrossile (- OH) attaccato all'anello benzenico.
Un'equazione del limite di risonanza è la struttura originale del fenolo, in cui gli elettroni della coppia solitaria dell'atomo di ossigeno non partecipano alla delocalizzazione;
In un'altra equazione limite, l'elettrone a coppia solitaria dell'atomo di ossigeno interagisce con il grande legame & pi; dell'anello benzenico, formando una caratteristica parziale a doppio legame tra l'atomo di ossigeno e l'anello benzenico. Allo stesso tempo, la densità delle nuvole di elettroni adiacenti e para sull'anello del benzene aumenta e la direzione del movimento degli elettroni è indicata dalle frecce. Più equazioni limite sono sovrapposte per descrivere la vera distribuzione della nuvola di elettroni del fenolo.
3. La manifestazione della struttura di risonanza nella reazione del fenolo
1. Casi di risposta specifici
La reazione del fenolo con l'acqua del bromo è un caso classico. Quando l'acqua di bromo viene aggiunta a goccia alla soluzione di fenolo, viene immediatamente prodotto un precipitato bianco, che è tribromofenolo.
2. Combinato con l'analisi della struttura di risonanza
Dal punto di vista della struttura di risonanza, l'atomo di bromo ha maggiori probabilità di attaccare queste due posizioni a causa dell'alta densità delle nubi di orto e para-elettrone del fenolo. Durante la reazione, gli atomi di bromo sostituiscono gradualmente gli atomi di idrogeno sull'anello benzenico e infine viene generato un precipitato bianco di tribromofenolo. Questo processo dimostra chiaramente il ruolo importante della struttura di risonanza nello spiegare la reazione chimica del fenolo.
3. Enfatizzare il ruolo delle strutture risonanti
Attraverso questo caso, abbiamo una comprensione più profonda della struttura di risonanza non è solo un concetto teorico, ma anche la chiave per comprendere la natura della reazione chimica del fenolo. È come un conduttore silenzioso, che guida la reazione chimica.
4. Il valore e la prospettiva di studiare la struttura di risonanza del fenolo
La struttura di risonanza fa sì che il fenolo abbia reattività, acidità e stabilità uniche, che determinano ulteriormente l'applicazione del fenolo in vari campi. In futuro, possiamo combinare metodi avanzati di chimica computazionale e tecniche sperimentali per studiare ulteriormente la struttura di risonanza del fenolo. Questo ci aiuterà a comprendere la natura e il comportamento del fenolo in modo più completo, a fornire un supporto più teorico e una guida pratica per lo sviluppo della chimica organica e a lasciare che il "generalista" del fenolo svolga un ruolo maggiore in più campi.

