Estructura de resonancia del fenol

1. Impresiones de la estructura de la resonancia del fenol
1. la amplia aplicación de fenol
Fenol, el "todo-ronged" en el campo de la química orgánica, brilla en muchos campos. En el campo de la medicina, es la materia prima clave para la síntesis de aspirina y otros medicamentos importantes, acompañando la salud humana; en la industria química, es la "fuerza principal" en la producción de resina fenólica, ayudando al desarrollo de la ciencia de los materiales; en la vida diaria, También se utiliza como materias primas desinfectantes para proteger nuestra salud y seguridad. Con una gama tan amplia de aplicaciones, el fenol se ha convertido en uno de los puntos calientes en la investigación de química orgánica.
2. conducen al concepto de estructura de resonancia
En el maravilloso mundo de la química orgánica, las estructuras resonantes son un modelo teórico único. Es como una llave mágica que puede ayudarnos a abrir la puerta al misterio de la distribución de electrones dentro de la molécula. Para el fenol, la estructura de resonancia es la clave para entender sus propiedades.
3. Proponer el propósito del estudio
En este documento, analizaremos profundamente la estructura de resonancia del fenol, exploraremos la relación interna entre él y las propiedades del fenol, y proporcionaremos una base teórica para que podamos comprender y utilizar mejor el fenol.
Formación, características y efectos de la estructura de resonancia de fenol
1. mecanismo de formación de la estructura de resonancia de fenol
(1) Base de la estructura molecular
El fenol consiste en un anillo de benceno y un grupo hidroxilo. El anillo de benceno tiene una gran estructura de enlace única en la que los electrones pueden moverse libremente por todo el anillo. Los átomos de oxígeno, por otro lado, tienen pares de electrones, que son como "elfos" escondidos en la oscuridad, esperando una reacción maravillosa con el anillo de benceno.
(2) Proceso deslocalizado de electrones
Cuando se forma la molécula de fenol, los electrones del par de electrones del átomo de oxígeno interactúan fuertemente con el gran & pi; enlace del anillo de benceno. Los electrones ya no están confinados a un átomo en particular, sino que se redistribuyen dentro de la molécula, formando múltiples fórmulas límite de resonancia. Esto es como un espectáculo de baile maravilloso, lanzadera libre electrónica en las moléculas, realizando una "danza electrónica" única.
(3) Superposición del tipo de límite de resonancia
Estas fórmulas de límite de resonancia no existen independientemente, sino que se superponen entre sí a través de resonancia. Son como un grupo de "miembros del equipo" trabajando juntos para describir la verdadera distribución de la nube de electrones de la molécula de fenol. Es esta superposición la que da a la molécula de fenol sus propiedades únicas.
2. características de la estructura de la resonancia del fenol
(1) Alta densidad de la nube de electrones para adyacente
Debido al efecto de resonancia, la densidad de nube de electrones de las posiciones adyacente y para en el anillo de benceno aumenta significativamente. A partir del diagrama esquemático, las nubes de electrones en estas dos posiciones son como bombillas "encendidas", que son particularmente llamativos. Esta alta densidad de nubes de electrones hace que los sitios orto y para sean más activos en reacciones químicas.
(2) la deslocalización de la carga negativa
Carga negativa en el anillo de benceno ocurrió fenómeno deslocalizado, como un grupo de aves libres, volando libremente en el "cielo" del anillo de benceno. Esta delocalidad reduce la energía molecular y hace que la estructura sea más estable, lo que sienta las bases para las propiedades químicas del fenol.
3. efecto de la estructura de la resonancia sobre las propiedades del fenol
1) Reactividad
Reacción de sustitución electrofílica: la alta densidad de la nube de electrones orto-para hace que el fenol sea más propenso a la reacción de sustitución electrofílica. Por ejemplo, en la nitración, sulfonación y otras reacciones, los reactivos atacarán preferentemente las posiciones orto y para generar los productos correspondientes, y los productos se concentran principalmente en las posiciones orto y para.
Selectividad de reacción: En algunas reacciones, el fenol exhibe una selectividad de reacción específica debido a la estructura de resonancia. Al igual que un comensal quisquilloso, que elige solo la "comida" que le gusta, esta selectividad brinda más posibilidades para la síntesis orgánica.
2) Acidez
La estructura de resonancia hace que sea más fácil para el hidrógeno hidroxilo fenólico disociarse, mejorando así la acidez del fenol. En comparación con los alcoholes, el fenol es significativamente más ácido, como una molécula más "picante", más propensa a liberar iones de hidrógeno.
3) Estabilidad
La energía de estabilización de resonancia reduce la energía de la molécula de fenol, haciendo que su estructura sea más estable y menos propensa a la descomposición o cambio. Esto hace que el fenol sea más confiable en el almacenamiento y uso, y proporciona una garantía para su amplia aplicación.
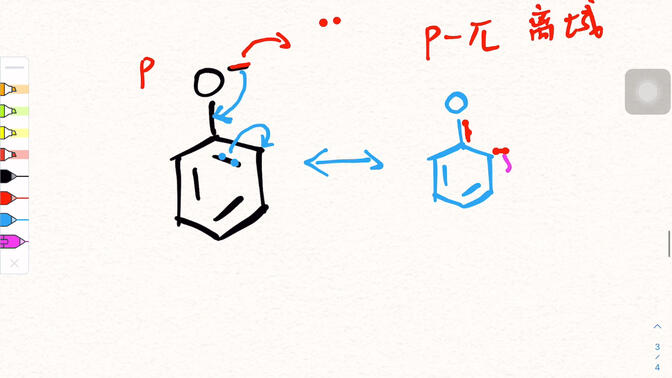
4. dibujar la estructura de resonancia de fenol
La estructura de resonancia del fenol se puede presentar a través de un diagrama esquemático simple.
La estructura básica del fenol es un grupo hidroxilo (- OH) unido al anillo de benceno.
Una ecuación de límite de resonancia es la estructura original del fenol, en la que los electrones pares de átomos de oxígeno no participan en la deslocalización;
En otra ecuación límite, el electrón de par único del átomo de oxígeno interactúa con el enlace & pi; -grande del anillo de benceno, formando un doble enlace parcial característico entre el átomo de oxígeno y el anillo de benceno. Al mismo tiempo, la densidad de nubes de electrones adyacentes y para en el anillo de benceno aumenta, y la dirección del movimiento de electrones se indica mediante flechas. Se superponen múltiples ecuaciones límite para describir la verdadera distribución de nubes de electrones del fenol.
3. la manifestación de la estructura de la resonancia en la reacción del fenol
1. Casos de respuesta específicos
La reacción de fenol con agua de bromo es un caso clásico. Cuando se añade agua de bromo gota a la solución de fenol, se produce inmediatamente un precipitado blanco, que es tribromofenol.
2. combinado con análisis de estructura de resonancia
Desde el punto de vista de la estructura de resonancia, es más probable que el átomo de bromo ataque estas dos posiciones debido a la alta densidad de las nubes de electrones orto y para de fenol. Durante la reacción, los átomos de bromo reemplazan gradualmente los átomos de hidrógeno en el anillo de benceno, y finalmente se genera un precipitado blanco de tribromofenol. Este proceso demuestra claramente el importante papel de la estructura de resonancia en la explicación de la reacción química del fenol.
3. enfatizar el papel de las estructuras resonantes
A través de este caso, tenemos una comprensión más profunda de la estructura de resonancia no es sólo un concepto teórico, sino también la clave para entender la naturaleza de la reacción química del fenol. Es como un conductor silencioso que guía la reacción química.
4. el valor y la perspectiva de estudiar la estructura de resonancia de fenol
La estructura de resonancia hace que el fenol tenga reactividad, acidez y estabilidad únicas, lo que determina aún más la aplicación de fenol en varios campos. En el futuro, podemos combinar métodos avanzados de química computacional y técnicas experimentales para estudiar más a fondo la estructura de resonancia del fenol. Esto nos ayudará a comprender la naturaleza y el comportamiento del fenol de manera más exhaustiva, brindará más apoyo teórico y orientación práctica para el desarrollo de la química orgánica, y permitirá que el "generalista" del fenol desempeñe un papel más importante en más campos.

