Fenolün rezonans yapısı

1. fenol rezonans yapısının izlenimleri
1. fenol geniş uygulama
Organik kimya alanında "all-ronged" olan fenol, birçok alanda parlıyor. Tıp alanında, insan sağlığına eşlik eden aspirin ve diğer önemli ilaçların sentezi için önemli bir hammaddedir; kimya endüstrisinde, fenolik reçine üretiminde "ana güç" dir ve malzeme biliminin gelişmesine yardımcı olur; günlük hayatta, Aynı zamanda dezenfektan hammadde olarak sağlık ve güvenliğimizi korur. Böyle geniş bir uygulama yelpazesi ile phenol, organik kimya araştırmalarında sıcak noktalardan biri haline geldi.
2. rezonans yapısı kavramına kurşun
Organik kimyanın harika dünyasında, rezonans yapıları benzersiz bir teorik modeldir. Molekülün içindeki elektron dağılımının gizemine kapıyı açmamıza yardımcı olabilecek sihirli bir anahtar gibidir. Fenol için, rezonans yapısı özelliklerini anlamanın anahtarıdır.
3. çalışmanın amacını önerin
Bu makalede, fenolün rezonans yapısını derinlemesine analiz edeceğiz, fenol ile fenolün özellikleri arasındaki iç ilişkiyi araştıracağız ve fenolü daha iyi anlamamız ve kullanmamız için teorik bir temel oluşturacağız.
2. fenol rezonans yapısının oluşumu, özellikleri ve etkileri
1. fenolün rezonans yapısının oluşum mekanizması
(1) moleküler yapının temeli
Fenol bir benzen halkası ve bir hidroksil grubundan oluşur. Benzen halkası, elektronların halka boyunca serbestçe hareket edebileceği eşsiz bir büyük ve pi'ye sahiptir. Öte yandan oksijen atomları, karanlıkta gizlenmiş "elfler" gibi, benzene halkasıyla harika bir tepki bekleyen yalnız elektronlara sahiptir.
(2) elektron delokalize süreci
Fenol molekülü oluştuğunda, oksijen atomunun yalnız çift elektronları büyük ve pi ile güçlü bir şekilde etkileşime girer; benzen halkasının bağı. Elektronlar artık belirli bir atomla sınırlı değildir, ancak çoklu rezonans limit formülleri oluşturan molekül içinde yeniden dağıtılır. Bu harika bir dans performansı, moleküllerdeki elektronik serbest mekik gibi, benzersiz bir "elektronik dans" gerçekleştiriyor.
(3) rezonans limit tipinin süperpozisyonu
Bu rezonans limit formülleri bağımsız olarak mevcut değildir, ancak rezonans yoluyla birbirine bindirilmiştir. Fenol molekülünün gerçek elektron bulut dağıtımını tanımlamak için birlikte çalışan bir grup "takım üyesi" gibidir. Fenol molekülüne eşsiz özelliklerini veren bu süperpozisyon.
2. fenol rezonans yapısı özellikleri
(1) bitişik para elektron bulutunun yüksek yoğunluğu
Rezonans etkisi nedeniyle, benzen halkasındaki bitişik ve para konumlarının elektron bulut yoğunluğu önemli ölçüde artar. Şematik diyagramdan, bu iki pozisyondaki elektron bulutları özellikle göz alıcı olan "aydınlatmalı" ampuller gibidir. Bu yüksek elektron bulut yoğunluğu, ortopedi ve para bölgelerini kimyasal reaksiyonlarda daha aktif hale getirir.
(2) negatif yükün delokalizasyonu
Benzen halkasında negatif yük, benzen halkasının "gökyüzünde" özgürce uçan bir grup serbest kuş gibi delokalize fenomen meydana geldi. Bu delocality, moleküler enerjiyi azaltır ve fenolün kimyasal özelliklerinin temelini oluşturan yapıyı daha kararlı hale getirir.
3. fenol özellikleri üzerinde rezonans yapısının etkisi
(1) reaktivite
Elektrofilik ikame reaksiyonu: orto-para elektron bulutunun yüksek yoğunluğu fenolü elektrofilik ikame reaksiyonuna daha eğilimli hale getirir. Örneğin, nitrasyonda, sülfonasyon ve diğer reaksiyonlarda, reaktanlar, ilgili ürünler üretmek için ortopedi ve para pozisyonlarına tercihli olarak saldırır ve ürünler ağırlıklı olarak ortho ve para pozisyonlarında yoğunlaşır.
Reaksiyon seçiciliği: bazı reaksiyonlarda fenol, rezonans yapısı nedeniyle belirli bir reaksiyon seçiciliği sergiler. Sadece seçici bir yiyici gibi, sadece sevdiği "yiyecek" yi seçerek, bu seçicilik organik sentez için daha fazla olasılık sağlar.
(2) asitlik
Rezonans yapısı, fenolik hidroksil hidrojenin ayrışmasını kolaylaştırır, böylece fenolün asitliğini arttırır. Alkollerle karşılaştırıldığında, fenol, hidrojen iyonlarını serbest bırakma olasılığı daha yüksek olan daha "keskin" bir molekül gibi önemli ölçüde daha asidiktir.
(3) kararlılık
Rezonans stabilizasyon enerjisi fenol molekülünün enerjisini azaltır, yapısını daha kararlı ve ayrışmaya veya değişime daha az eğilimli hale getirir. Bu, fenolü depolama ve kullanımda daha güvenilir hale getirir ve geniş uygulaması için bir garanti sağlar.
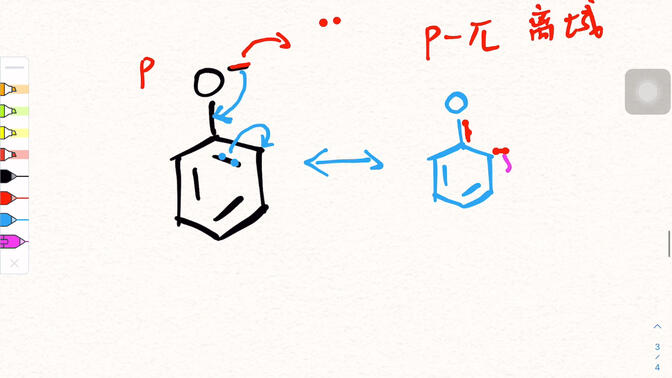
4. fenolün rezonans yapısını çizin
Fenolün rezonans yapısı basit bir şematik diyagramla sunulabilir.
Fenolün temel yapısı, benzen halkasına bağlı bir hidroksil grubudur (-oh).
Bir rezonans limit denklemi, oksijen atomu yalnız çift elektronların delokalizasyona katılmadığı fenolün orijinal yapısıdır;
Başka bir limit denkleminde, oksijen atomunun yalnız çift elektron büyük ve pi ile etkileşime girer;-benzen halkasının bağlanması, oksijen atomu ve benzen halkası arasında kısmi çift bağ özelliği oluşturur. Aynı zamanda, benzen halkasındaki bitişik ve para elektron bulutlarının yoğunluğu artar ve elektron hareketinin yönü oklarla gösterilir. Fenolün gerçek elektron bulut dağıtımını tanımlamak için çoklu limit denklemleri üst üste konur.
3. fenol reaksiyonunda rezonans yapısının tezahürü
1. özel yanıt durumları
Fenolün bromine su ile reaksiyonu klasik bir durumdur. Fenol çözeltisine bromin suyu eklendiğinde, tribromofenol olan beyaz bir çökelti hemen üretilir.
2. rezonans yapı analizi ile kombine
Rezonans yapısının bakış açısından, brom atomu, fenolün ortho ve para-elektron bulutlarının yüksek yoğunluğuna bağlı olarak bu iki pozisyona daha fazla saldırması muhtemeldir. Reaksiyon sırasında, bromin atomları yavaş yavaş benzen halkasındaki hidrojen atomlarını değiştirir ve sonunda tribromofenolün beyaz bir çökelti oluşur. Bu süreç, fenolün kimyasal reaksiyonunu açıklamada rezonans yapısının önemli rolünü açıkça göstermektedir.
3. rezonans yapılarının rolünü vurgulayın
Bu durumda, rezonans yapısının daha derin bir anlayışına sahibiz, sadece teorik bir kavram değil, aynı zamanda fenolün kimyasal reaksiyonunun doğasını anlamanın anahtarı. Kimyasal reaksiyonu yönlendiren sessiz bir iletken gibidir.
4. fenolün rezonans yapısını incelemenin değeri ve umudu
Rezonans yapısı fenolün çeşitli alanlarda fenolün uygulanmasını belirleyen benzersiz bir reaktivite, asitlik ve stabiliteye sahip olmasını sağlar. Gelecekte, fenolün rezonans yapısını daha fazla incelemek için gelişmiş hesaplamalı kimya yöntemlerini ve deneysel teknikleri birleştirebiliriz. Bu, fenolün doğasını ve davranışını daha kapsamlı bir şekilde anlamamıza, organik kimyanın geliştirilmesi için daha teorik destek ve pratik rehberlik sağlamamıza ve fenolün "generalistinin daha fazla alanda daha büyük bir rol oynamasına izin vermemize yardımcı olacaktır.

